Hiep hoi, de Falsified Medicines Directive is bijna jarig! In januari bestaat de EU-richtlijn die verspreiding van vervalste medicijnen moet tegengaan vijf jaar. Dat vieren we niet met een taart en een lied, maar met een blog waarin we eens kijken wat die Falsified Medicines Directive nu eigenlijk precies voorschrijft. Is dat niet een beetje laat? Misschien wel, maar vanaf begin volgend jaar zijn alle transitieperiodes voltooid en de gevolgen van de FMD pas écht goed merkbaar. En beter laat dan nooit, toch?
Wat is de Falsified Medicines Directive?
Nee, de EU gaat niet alleen over hoe krom onze komkommers mogen zijn. Het grootste deel van de tijd zijn de heren en dames in Brussel hartstikke nuttig bezig. De Falsified Medicines Directive is hier een prima voorbeeld van. In de FMD (2011/62 EU) hebben de EU-lidstaten maatregelen afgesproken waarmee moet worden voorkomen dat vervalste medicijnen de Europese markt bevuilen. Dit doen ze door enerzijds striktere regels op te leggen aan producenten en importeurs van medicijnen en anderzijds anderzijds afspraken te maken voor een beter toezicht op de farmaceutische bevoorradingsketen.

Is dat nu allemaal echt nodig?
Die rare mailtjes vol met spelfouten over ‘penis enlargement pills’ gaan bij u natuurlijk rechtstreeks de map ‘verwijderde items’ in. Zijn vervalste medicijnen dan eigenlijk wel zo’n groot probleem? Toch wel. Om te beginnen is de FMD er niet alleen voor opzettelijk vervalste medicijnen, maar ook voor onbetrouwbare ‘sub-standard’ medicijnen. Dit zijn bijvoorbeeld medicijnen waarvan de houdbaarheidsdatum is verlopen, waarvan de kwaliteit onder de maat is of die niet zijn gecontroleerd dan wel goedgekeurd voor de markt waarin ze worden aangeboden. In al deze gevallen kan het gebeuren dat de medicijnen niet doen wat ze moeten doen. Of erger nog, dat ze gevaarlijk zijn voor de gezondheid.
Daarnaast is het probleem van slechte medicijnen veel groter dan een paar overduidelijk onbetrouwbare webwinkels. Tussen 2013 en 2017 is er bij de WHO, de wereldgezondheidsorganisatie, zo’n 1500 keer melding gemaakt van vervalste of slechte medicijnen en dit is waarschijnlijk nog maar het topje van de ijsberg. Slechte medicijnen zijn in de eerste plaats een probleem in armere continenten, zoals Afrika. De WHO schat in dat in ontwikkelingslanden 1 op de 10 medicijnen slecht of vervalst is. Toch komt nog altijd een vijfde van de meldingen uit Europa. En dan gaat het niet alleen om pillen van dubieuze websites of dancefeesten. Er zijn ook valse medicijnen aangetroffen in apotheken, klinieken en ziekenhuizen. Denk hierbij aan o.a. niet-werkende anti-malaria, antibiotica, kankermedicijnen en anticonceptiepillen. Soms niet van echt te onderscheiden!
Hoe lost de FMD dat op?
Die valse medicijnen daar willen we vanaf en de Falsified Medicines Directive gaat ons daarbij helpen. Hieronder de vier belangrijkste punten uit het document die moeten bijdragen aan een veiligere Europese markt voor medicijnen.
1. Strengere regels
De lidstaten moeten hun regels, mechanismen en controles aanscherpen om te voorkomen dat slechte of vervalste medicijnen de Europese markt betreden. Er dient registratie en autorisatie plaats te vinden van producenten, importeurs en distributeurs van medicijnen. Als bij inspectie blijkt dat een partij niet volgens de regels opereert dan kan de licentie worden ingetrokken.
2. Een EU-keurmerk voor online apotheken
Online verkopers zijn een stuk lastiger te controleren dan fysieke apotheken. Een Nederlandse webwinkel kan bijvoorbeeld prima worden beheerd vanuit Rusland of China. Dat maakt inspectie al snel onmogelijk. Officiële online verkopers van medicijnen krijgen daarom voortaan een logo met een link naar een nationaal register waarin de registratie/autorisatie van de verkoper gecontroleerd kan worden. Het logo bevat de vlag van het land waar de verkoper is geautoriseerd.

EU-logo voor online verkopers van medicijnen
3. Verzegelde verpakkingen
De verpakkingen van medicijnen worden voorzien van een verzegeling met echtheidskenmerken, het zogenaamde ‘anti-tampering device’. Hiermee kan op elk moment in de keten worden gecontroleerd dat er niet met de verpakking is gerommeld. In principe geldt deze verplichte verzegeling niet voor medicijnen die zonder recept verkocht mogen worden. Wel kan een lidstaat zo’n specifiek ‘zelfzorgmedicijn’ alsnog verplicht laten verzegelen wanneer er een vastgesteld risico op vervalsing is.
4. Unieke identificatie
Elke verpakking van medicijnen krijgt voortaan een 2D datamatrix barcode met een unieke identificatie (een serienummer). Deze barcode kan daarnaast meer informatie bevatten, zoals een artikelcode, batchnummer en houdbaarheidsdatum. Vanaf februari 2019 is het verplicht bij de uitgifte van medicijnen deze barcode te scannen om de informatie te controleren in een Europese database. Voor die tijd moeten alle barcodescanners dus de datamatrix barcode ondersteunen. Medicijnen die niet geverifieerd kunnen worden mogen niet worden uitgegeven.
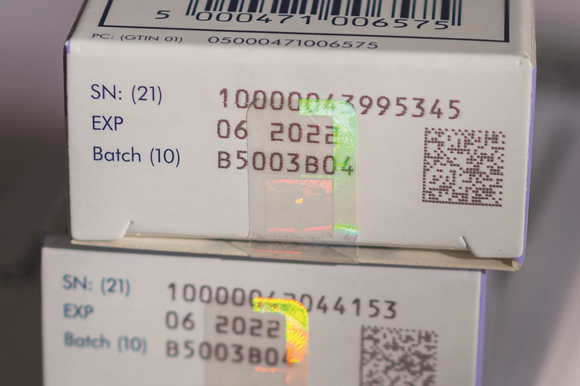
Medicatieverpakking met verzegeling en 2D-barcode (foto: Jonathan Buisson)
Het verdere nut van een barcode
Die 2D barcode die straks op elk doosje medicijnen staat helpt niet alleen om vervalsing tegen te gaan maar lost ook een ander probleem op: we weten niet genoeg. Zoals Wayne Miller van Zebra eens stelde: ‘Amazon weet meer over de spullen die je hebt gekocht dan dat je dokter weet over de medicijnen die je hebt gekregen.’ Dat is best raar. En onhandig. Want wat als we er achter komen dat er bij de productie van een bepaalde batch medicijnen (mogelijk) iets is misgegaan? Dan kunnen we nu niets doen, omdat we niet weten aan wie die medicijnen zijn uitgegeven. De 2D-barcode lost dit op. Bij het uitgeven van de medicatie wordt de barcode gescand en wordt alle informatie over het medicijn opgenomen in het Elektronisch Patiëntendossier. Zo is er een complete uitgifteregistratie en kunnen we elk afzonderlijk doosje tot aan de patiënt herleiden.
Nog vragen?
Heeft u na het lezen van dit blog nog vragen over de Falsified Medicines Directive? Stel ze vooral in de reacties onder dit blog!
Bronnen:
https://en.wikipedia.org/wiki/Falsified_Medicines_Directive
https://ec.europa.eu/health/human-use/falsified_medicines_nl
https://ec.europa.eu/health/human-use/eu-logo_en
https://www.knmp.nl/praktijkvoering/regelgeving/copy_of_falsified-medicines-directive-fmd/veelgestelde-vragen-fmd
https://www.knmp.nl/praktijkvoering/regelgeving/copy_of_falsified-medicines-directive-fmd/falsified-medicines-directive-fmde
https://www.who.int/news-room/fact-sheets/detail/substandard-and-falsified-medical-products
https://www.who.int/news-room/detail/28-11-2017-1-in-10-medical-products-in-developing-countries-is-substandard-or-falsified


